根据下列反应: (1) 2Fe3+ +2I- = 2Fe2+ +I2 (2) Br2 + 2Fe2+ = 2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是
| A.Br- > I-> Fe2+ | B.I- > Fe2+ > Br- | C.Fe2+ > I-> Br- | D.Br- > Fe2+ > I- |
下列说法中,正确的是( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
已知:HCN(aq)与NaOH(aq)反应的∆H= -12.1kJ/mol;HCl(aq)与NaOH(aq)反应的∆H= -55.6kJ/mol。则HCN在水溶液中电离的∆H等于()
| A.+67.7kJ/mol | B.-67.7 kJ/mol | C.+ 43.5 kJ/mol | D.-43.5 kJ/mol |
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
| 改变条件 |
新平衡与原平衡比较 |
|
| A |
增大压强 |
N2的浓度一定变小 |
| B |
升高温度 |
N2的转化率变小 |
| C |
充入一定量H2 |
H2的转化率不变,N2的转化率变大 |
| D |
使用适当催化剂 |
NH3的体积分数增大 |
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )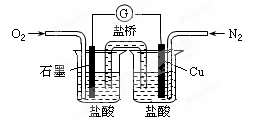
| A.此装置能将化学能转变为电能 |
| B.石墨电极的反应式:O2+2H2O+4e—=4OH— |
| C.电子由Cu电极经导线流向石墨电极 |
| D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( )
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2+ + 2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |