下列离子方程式书写不正确的是
| A.常温下氯气与烧碱溶液反应:Cl2 + 2OH - ══ Cl- + ClO- + H2O |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O══ Al(OH)3↓+3NH4+ |
| C.铜与稀硫酸反应:Cu + 2H+══ Cu2+ + H2↑ |
| D.FeCl3溶液中加入KSCN:Fe3++3SCN一══Fe(SCN)3 |
下列说法不正确的是
| A.分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B.具有相同通式的有机物不一定互为同系物 |
| C.两个相邻同系物的相对分子质量数值一定相差14 |
| D.分子组成相差一个或若干个CH2原子团的化合物必定互为同系物 |
下列关于有机物的命名中不正确的是
| A.2,2─二甲基戊烷 | B.2─乙基戊烷 |
| C.3,4─二甲基辛烷 | D.3─甲基己烷 |
下列物质属于有机物的是
A.氰化钾(KCN) B.碳酸氢钾(KHCO3) C.乙炔(C2H2) D.碳化硅(SiC)
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示的步骤分开五种离子。下列判断正确的是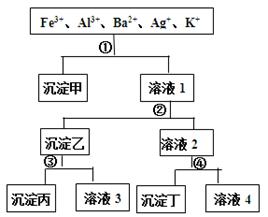
| A.沉淀乙是氢氧化铝和氢氧化银的混合物 |
| B.溶液3中含有Al3+ |
| C.溶液4含有三种阳离子,分别是H+、Na+、K+ |
| D.试剂①是NaCl,试剂④是H2SO4 |
下列说法正确的是
| A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+) + c(CH3COOH) =" 2" c(OH-) + c(CH3COO-) |
| D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |