下列事实能说明HA酸是弱电解质的是
| A.浓度相同时HA溶液的导电性比强酸弱 |
| B.10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 |
| C.NaA溶液的pH>7 |
| D.0.1 mol/L HA溶液的pH=1 |
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为
| A.84% | B.60% | C.91% | D.42% |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:1的化合物是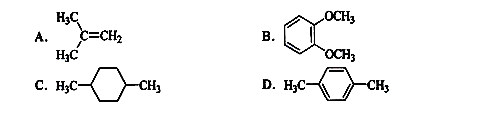
能在KOH的醇溶液中发生消去反应的是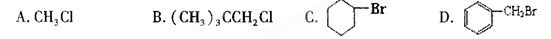
2012年的伦敦奥运会中,某种兴奋剂(结构如图所示)是本届奥运会运动员禁止使用的药物之一,关于它的说法正确的是 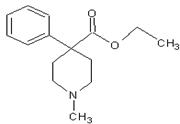
| A.该物质的分子式为C15H21NO2 |
| B.该物质属于烃的含氧衍生物 |
| C.该物质分子中所有碳原子共面 |
| D.该物质能发生的反应类型有:取代、水解、消去反应 |
右图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是:()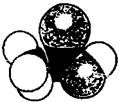
| A.C2H5OH | B.C6H5OH | C.CH3CHO | D.CH3COOH |