(10分)下图所涉及的物质中,C、D、E均为单质, 且E为日常生活中常见金属,其余均 为化合物
且E为日常生活中常见金属,其余均 为化合物 。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。
。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。

请回答:
(1)写出有关物质的化学式
A ,F ,H 。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 (填化学式)。
(4)写出反应②的化学方程式 。
(5)向G中加入NaOH溶液,观察到的现象为 。
将煤焦油中混有的苯、甲苯与苯酚进行分离,可采取如图所示的方法进行操作: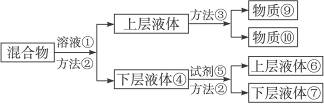
(1)写出物质①和⑤的化学式:①为________,⑤为________。
(2)写出分离方法:②为________法,③为________法。
(3)混合物中加入溶液①反应的化学方程式________________________。
(4)下层液体④变成⑥⑦的方程式为______________________________。
(5)分离出的苯酚在________里(写编号)。
已知提供H+的能力:H2CO3>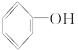 >
>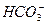 >H2O>CH3CH2OH,试写出下列可发生的反应方程式。
>H2O>CH3CH2OH,试写出下列可发生的反应方程式。
(1)CO2通入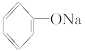 溶液中__________________;
溶液中__________________;
(2)Na2CO3溶液滴入苯酚溶液中___________________;
(3)乙醇钠投入水中______________________________;
(4)金属钠投入熔融苯酚中________________________。
A、B、C三种物质分子式为C7H8O,若滴入FeCl3溶液,只有C呈紫色;若投入金属钠,只有B没有变化。在A、B中分别加入溴水,溴水不褪色。
(1)写出A、B、C的结构简式:A___________,B___________,C___________。
(2)C的另外两种同分异构体的结构简式是:①___________,②___________。
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气。A不溶于NaOH溶液,而B能溶于NaOH溶液,B能使适量溴水褪色,并产生白色沉淀,A不能。B的一溴代物有两种结构,写出A和B的结构简式________________和名称_________________。
A、B、C、D四种有机分子中碳原子数相同,A为气态,标准状况下的密度为1.16 g·L-1,B或D跟HBr反应都生成C,D在浓H2SO4存在下发生消去反应生成B,则:
(1)A、B、C、D的结构简式分别为:A_________,B_________,C_________,D_________。
(2)写出下列各步反应的方程式:
B→C_________________________________;
D→C_________________________________;
D→B_________________________________。