某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答下列问题: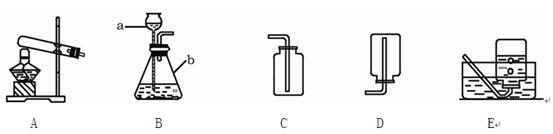
(1)写出图中标号仪器的名称:a ,b 。
(2)用双氧水和二氧化锰制取氧气时,可选用的发生装置是 (填上图字母),可选用C装置收集氧气,其原因是 。
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应选择的发生装置是 (填上图字母)。
(4)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是 (填字母)。
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用工、Ⅲ装置制得二氧化碳并验证其性质。实验室制取二氧化碳的化学方程式是 ;若要证明二氧化碳能与水发生反应,应向烧杯的水中加入 。
小华同学配制50g溶质质量分数为20%的NaCl溶液,操作流程如题图:
(1)小华同学应称取氯化钠的质量是
(2)指出图中的一处错误:
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘左侧,他接下来的操作是
(4)在用量简量取水的过程巾,当液面接近刻度线时,他的操作如题图所示,其中规范的是(填序号)。
(5)如果小华配制的氯化钠溶液的溶质质量分数小于20%,则造成此误差的可能原因有
(填序号)。
A.称量前天平没有调平 B.称量纸上残留少量食盐
C.向烧杯中加水时,有少量水溅出烧杯外
某化学兴趣小组选用题16图所示装置,进行CO2制取和性质实验,请你根据所学知识,依图回答下列问题:
(1)仪器①的名称为
(1)收集少量CO2气体应选择(填装置序号)。
(3)若A与D连接,则D中出现的现象是,原因是(用化学方程式表示)。
(4)若A与F连接,则F中低的蜡烛先熄灭,高的蜡烛后熄灭,由此说明了CO2的性质有
、
某化学课外兴趣小组探究氢气还原氧化铜的反应,有如下实验装置:
⑴上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳的化学方程式;。
⑵请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.Cu和Cu2O均为不溶于水的红色固体;Ⅱ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含有Cu;假设二:红色固体只含Cu2O;
假设三:(请补充完成假设三)。
②实验探究:(填写表中空格)
| 实验操作 |
实验现象 |
实验结论 |
| a.取少量红色固体加入到足量硫酸溶液中 |
无明显现象 |
假设成立 |
| b.取少量红色固体加入到足量硫酸溶液中 |
假设二和假设三均成立 |
③数据处理:甲同学称取Wg红色固体加入到足量硫酸溶液中使其充分反应后,(填操作名称)、洗涤、干燥,称量剩余红色固体质量为mg,通过计算,若m  (选填>、<或=),则假设二成立;若m
(选填>、<或=),则假设二成立;若m  (选填>、<或=),则假设三成立。
(选填>、<或=),则假设三成立。
④交流与反思:只要假设合理,实验方法正确,根据实验现象和数据就能得出结论。
通过半年的化学学习,你对化学实验有了一些认识,请你解答下列问题:
(1)在电解水的实验中,两电极相连的玻璃管上方产生的气体是和,两者的体积比约为,这个实验证明了水是由组成。该反应的化学方程式为。
(2)根据下图所示实验装置回答下列问题:
①用氯酸钾和二氧化锰混合加热制取O2应选用的发生装置(填序号,下同)____;若用高锰酸钾加热制取O2该装置还需做的一点改动是;用过氧化氢溶液和二氧化锰混合制取O2应选用_________;制取H2应选用__________;
制取CO2应选用_______,反应的化学方程式为。
②收集O2可选用________, 理由是; 收集CO2应选用。
(3)过滤操作中的要点常简记为“一贴二低三靠”,请你解释“三靠”的具体含义:。
“三靠”:①,② ,
③。
现有氯酸钾、二氧化锰、锌粒、稀硫酸、氧化铜等药品,请利用所给的药品结合下列实验装置图回答问题.(收集装置不能重复使用)
A  B
B  C
C 
D  E
E F
F 
(1)写出实验室制取氧气的文字表达式______________________;制取氧气应选用的装置是_______和_______。(填字母)
(2)实验室制取氢气应选用的装置是_________和_________。(填字母)
(3)实验室中一般用铜与浓硝酸在常温下反应迅速产生二氧化氮气体。二氧化氮气体比氧气密度大,易溶于水。试用你学过的实验室制氧气和制氢气的知识回答:实验室用于制二氧化氮气体的发生装置可用(填序号)_________,收集二氧化氮气体的装置为_________