(10广东省22)请根据下列装置,回答问题:
(1)写出标号①②的仪器名称:①_________,②__________。
(2)实验室制取CO2的反应方程式为_________________________________;检验收集的气体是否是二氧化碳的原理是___________________(用方程式表示)
(3)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是____________(填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(4)在实验室抽取CO2的实验装置中,F装置相对于B装置具有的优点是______________
________________________________________。
(5)实验室通过多种反应可以得到NH3(极易溶于水,密度比空气小),例如:2NH4Cl(固)+Ca(OH)2(固)△CaCl2+2NH3↑+2H2O
你将选择上图中的 作为实验室收集NH3的装置。下图是收集NH3并对尾气进行处理的装置(浓硫酸可以与NH3反应生成硫酸铵),请根据图示把装置画完整。
上图中漏斗倒放的作用是防止倒吸。
下列物质:①河水②水银③冰水混合物④液态氮⑤澄清石灰水⑥五氧化二磷⑦洁净的空气⑧氯化钠,用正确序号填空:
属于混合物的是 ;属于纯净物的是 ;
属于单质的是 ;属于化合物的是 。
用化学符号填空:
(1)氖气 ; (2)氯化铁 ;
(3)3个硝酸根离子 ;(4)氧化钙中钙元素的化合价为+2 ;
(5)地壳中含量最高的金属元素是 ;
(6)空气中含量最多的气体是 。
用下列化学用语填空:
稀释乳化过滤氧化蒸馏溶解吸附
(1)降低水硬度的方法 ;
(2)除去河水中泥沙的方法 ;
(3)用活性炭除去毒气 ;
(4)将溶液溶质质量分数变小 。
今年九月,我国发生“三鹿牌”奶粉受污染事件,导致食用受污染奶粉婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺,牛奶和奶粉中加入三聚氰胺,是因为它能冒充蛋白质,这种不法行为应该受到法律的处理.
三聚氰胺分子中碳、氮、氢的原子数之比为 ;
三聚氰胺中碳、氮、氢三种元素质量之比为 ;
三聚氰胺中氮元素的质量分数为 .
请结合下列实验常用装置,回答有关问题.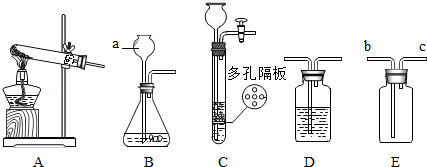
图中仪器a的名称: .
若用高锰酸钾制取氧气,应选用的发生装置是 ,在加入药品前,应首先 ,加药品后试管口还应放置一团 ,反应的化学方程式是 .
若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入 ,反应的化学方程式是 . 如果用E装置收集该气体,则气体从 端进入.
实验室如用块状固体和液体无需加热制取难溶性气体,可将B装置改进为C装置,其优点是 .