下列说法正确的是
①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中—定有大量CO32-存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)﹥c(CH3COO—)﹥c(OH—)﹥c(H+);
⑥下图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2 A(g)+ B(g) =" 2" C(g);△H="Q" kJ·mol-1(Q<0 )。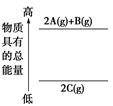
| A.①③⑥ | B.②④⑤ |
| C.①③④ | D.③⑤⑥ |
关于下列各装置图的叙述中,不正确的是
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
| A.碳棒接直流电源的负极 |
| B.碳棒上发生还原反应 |
| C.铁片上的电极反应式为2Cl――2e- = Cl2↑ |
| D.铁片附近出现的浑浊物是Mg(OH)2 |
下列有关反应热的说法中正确的是
| A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 |
| B.中和热△H=-57.3kJ•mol-1,所以,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰 好完全反应放出57.3kJ的热量 |
| C.用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验与 用等体积的0.50mol•L-1盐酸、0.50mol•L-1NaOH溶液进行中和热测定的实验相比,前者会使测得的中和热的数值偏大 |
| D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热 |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×
10-36mol2·L-2。 下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现 的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl——e—=AgCl |
| B.AgCl是还原产物 |
| C.Na+不断向“水”电池的负极移动 |
| D.每生成1 mol Na2Mn5O10转移2 mol电子 |