(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)  。
。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)利用ClO2氧化氮氧化物反应过程如下: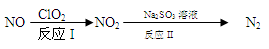
反应I的方程式是2NO+ClO2+H2O ="=" NO2+HNO3+HCl,该反应的氧化产物为,
反应II的化学方程式为。
(2)可用甲烷催化还原氮氧化物。已知:
CH4(g) + 4NO2(g) ="==" 4 NO(g) + CO2(g) + 2H2O(g)ΔH1
CH4(g) + 4NO(g) ="==" 2 N2(g) + CO2(g) + 2H2O(g)ΔH2
①已知NO气体会分解为NO2气体和N2气体,写出该反应的热化学方程式。
②现有一份NO与NO2的混合气体,其平均相对分子量为34,用16g甲烷气体催化还原该混合气 体,恰好完全反应生成氮气,二氧化碳气体和水蒸气,共放出热量1042.8kJ。则该混合气体中NO和NO2的物质的量之比为,若已知上述反应ΔH2= —1160 kJ·mol-1,则ΔH1=。
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2— 形式存在。目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-=2AlO2-+OH-+H2O。现以Al—H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(右池中隔膜仅阻止气体通过,b、c、d均为惰性电极)。试回答下列问题
电极b是极,电极反应式为,
(2)右池是池,电极c的电极反应式为,
(3)通电2min后,Al电极质量减轻2.7g,则产生氮气的体积为。(标准状况)
已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+→ Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
| 组别 |
温度/℃ |
V(H2C2O4) /mL |
V(KMnO4) /mL |
V(H2O) /mL |
KMnO4溶液 褪色时间/s |
| 1 |
30 |
10 |
10 |
20 |
40 |
| 2 |
30 |
20 |
20 |
0 |
t |
| 3 |
30 |
15 |
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40B.=40 C.<40 D.无法判断
T1温度下,反应2SO2(g)+O2(g) 2SO3(g) △H<0的平衡常数K=532.4。
2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K=,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)="0.0600" mol·L-1,c(O2)="0.400" mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为。
(2)该反应△S0,升高温度,平衡常数(填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
2molSO2、1molO2 |
4molSO3 |
| 平衡时n(SO3)/mol |
1 |
m |
| 反应物的转化率 |
1 |
2 |
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,1+21(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。