某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所 示。下列说法正确的是
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数 Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数 Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。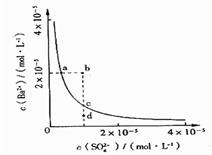
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
| 选项 |
Ⅰ |
Ⅱ |
| A |
Ba(OH)2溶液与过量NaHCO3溶液混合 |
NaOH溶液与过量NaHCO3溶液混合 |
| B |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入Ba(OH)2溶液中 |
| C |
BaCl2溶液与Na2SO3溶液混合 |
Ba(OH)2溶液与H2SO3溶液混合 |
| D |
少量氨水滴入AlCl3溶液中 |
少量AlCl3溶液滴入氨水中 |
下列说法中正确的是 ( )
| A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L |
| B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子 |
| C.1 mol氯气溶于水转移6.02× 1023个e— |
| D.0.1 mol CH5+含6.02 × lO23个e一 |
某溶液中可能含有K+、NH4+、Ba2+、SO42一、I一、 CO32一。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )
| A.K+ | B.SO42一 | C.Ba2+ | D.NH4+ |
MnO2的一些性质或用途如图,下列说法正确的是 ( )
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 (. )
| 选项 |
离子或分子 |
要求 |
| A |
K+ 、NO3-、Cl-、HS- |
c(K+)<c(Cl-) |
| B |
Fe3+、NO3-、SO32-、Cl- |
滴加盐酸立即有气体产生 |
| C |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH溶液立即有气体产生 |
| D |
Na+、HCO3-、Mg2+、SO42- |
逐滴滴加氨水立即有沉淀产生 |