0.2 mol锌和足量的稀盐酸反应,在标准状态下生成氢气的体积是
| A.4.48 L | B.2.24 L | C.1.12 L | D.0.2 L |
下列关于氨气的说法正确的是( )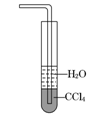
| A.氨气可以用浓硫酸干燥也可用碱石灰干燥 |
| B.氨水能导电,所以NH3是电解质 |
| C.稳定性:NH3<CH4 |
| D.用水吸收NH3用右图装置可防止倒吸 |
一种酸性较强的溶液中,可能存在NO3—、I-、Cl-和Fe3+中的一种或几种,向该溶液中加入溴水后,溴单质被还原,由此可推知这种溶液中( )
| A.含I-,不能确定是否含Cl- |
| B.含NO3— |
| C.含I-、NO3—、Cl- |
| D.含Fe3+ |
下列表述正确的是( )
①四氧化三铁是红棕色粉末,俗称铁红
②“加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
③化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是二氧化硅
④工艺师利用盐酸刻蚀石英玻璃制作艺术品
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
| A.①②③ | B.②④ |
| C.③④⑤ | D.③⑤ |
对于下列事实的解释错误的是( )
| A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
| D.浓硫酸常温下与铜不反应,加热时才能发生反应 |
某化学兴趣小组对某奖牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为证明甲、乙、丙猜想的正误,可取少量制造该奖牌的材质粉末,加入一种试剂,该试剂应是
| A.硫酸铜溶液 | B.硝酸银溶液 | C.盐酸 | D.稀硝酸 |