已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是:
| A.H2O(g)=H2(g)+1/2O2(g)ΔH=+242kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-484kJ·mol-1 |
| C.H2(g)+1/2O2(g)=H2O(g)ΔH=+242kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1 |
已知2SO2 (g)+O2 (g) 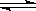 2SO3 (g);△H =﹣197kJ•mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
2SO3 (g);△H =﹣197kJ•mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
| SO2 (mol) |
O2 (mol) |
SO3 (mol) |
|
| 甲 |
2 |
1 |
0 |
| 乙 |
4 |
2 |
0 |
| 丙 |
0 |
0 |
2 |
恒温、恒容下反应达平衡时,下列关系一定正确的是
A.SO3的质量m:2m甲 = m乙
B.容器内压强P:2P丙 > P乙
C.反应放出或吸收热量的数值Q:Q甲 > Q丙
D.c(SO2)与c(O2)之比a:a丙 > a乙
(原创)向100mL 0.1mol/L醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是
已知有反应:I2(g)+H2(g) 2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
| 选项 |
X |
Y |
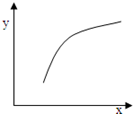 |
| A |
温度 |
容器内混合气体的密度 |
|
| B |
I2的物质的量 |
H2的转化率 |
|
| C |
H2的浓度 |
平衡常数K |
|
| D |
加入Ar的物质的量 |
逆反应速率 |
(原创)科学家发现海洋是一个名副其实的“聚宝盆”,一些国家觊觎我国南海海域的丰富资源,导致近年来南海争端不断。下列对海洋资源开发利用的说法不正确的是
| A.海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质 |
| B.海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等 |
| C.海水中的金、铀等元素储量高、浓度低,提炼时,须先富集 |
| D.海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
| A.移走部分PbCrO4固体,Cr2O72-转化率升高 |
| B.升高温度,该反应的平衡常数(K)增大 |
| C.加入少量NaOH固体,自然沉降后,溶液颜色变浅 |
| D.加入少量K2Cr2O7固体后,溶液中c(H+)不变 |