20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
| A.酸性HY>HX |
B.结合H+的能力Y->CO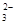 >X->HCO >X->HCO |
| C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.HX和HY酸性相同但比H2CO3弱 |
下列说法错误的是
| A.二氧化碳和漂白粉作用,生成具有氧化性的物质 |
| B.二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 |
| C.二氧化硅和烧碱反应,使溶液的碱性一定减弱 |
| D.二氧化氮可相互结合为四氧化二氮 |
下列说法正确的是
| A.原子电子层数越多,半径越大 |
| B.在Mg、Al、NaOH溶液构成的原电池中,因为Al作负极,Mg作正极,所以Al的金属性大于Mg |
| C.俄罗斯专家首次合成了一个116178X原子,116号原子位于元素周期表中第七周期ⅥA族 |
| D.原子最外层电子数大于3(小于8)的元素一定是非金属元素 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
C.该过程中总反应为2Al+3Ag2S 6Ag+Al2S3 6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是
| A.放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B.电池的电解液可为KOH溶液 |
| C.充电时负极反应为:MH+OH-→M+H2O+e- |
| D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,
下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体 |