已知K2HPO4溶液中水解程度大于电离程度,对于平衡HPO42-+H2O 
 H3O++PO43-,欲使溶液中
H3O++PO43-,欲使溶液中
c(HPO42-)、c(PO43-)、c(H3O+)三种离子浓度均减少,可采用的方法是( )
| A.加水 | B.加热 | C.加消石灰 | D.加AgNO3 |
关于溶液的酸碱性说法正确的是
| A.c(H+)很小的溶液一定呈碱性 | B.pH=7的溶液一定呈中性 |
| C.c(OH-)=c(H+)的溶液一定呈中性 | D.不能使酚酞试液变红的溶液一定呈酸性 |
下列事实不能用勒夏特列原理解释的是
| A.实验室可以用排饱和食盐水的方法收集氯气 |
| B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快 |
| C.高压有利于工业上合成氨 |
| D.打开汽水瓶时,瓶中立即泛起大量泡沫 |
在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-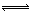 [CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
| A.蒸发浓缩 | B.加CuCl2固体 | C.加入AgNO3 | D.加入食盐晶体 |
在理论上不能用于设计原电池的化学反应是
| A.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H < 0 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H < 0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H < 0 |
| D.2H2(g)+O2(g)=2H2O(l) △H < 0 |
下列描述违背化学原理的是
| A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-= Cl2 ↑ |