以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶。请回答下列问题:
⑴上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去。
⑵①中加入的试剂应该选择_______________ ____________为宜。
____________为宜。
⑶②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
⑷下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。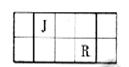
(1)元素T在周期表中位于第_________族。
(2)J和氢组成的化合物A每个分子由4个原子组成,其结构简式为________________,已知充分燃烧agA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是_______________________________。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为___________________________________________________。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
_____ _。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:______________________。
(6)其中L、M、R形成的氢化物沸点由高到低的顺序是______________________(用化学式表示)
下图中P为一可自由滑动的活塞,K为容器A和B之间的旋塞。将K关闭,在A中充有1molX和1molY,B中充有3molX和3molY。起始时,V(A)=V(B)=1L,在相同的温度和有催化剂存在的条件下,两容器中各自发生反应:
X(g)+Y(g) 2Z(g)+W(g);△H<0。
2Z(g)+W(g);△H<0。
当达到平衡时,V (A)=1.25L。问: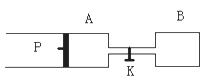
(1)A中Y的转化率为,A、B中Y的转化率的关系是a(A) a(B)(填“<”、“>”或“=”)。
(2)如果将B端改装成与A端一致(如下图),
将K关闭,达到平衡后,B的体积为______L,
B中X的体积分数为___________________。
此时,如果将K打开,A中活塞_________(填“移动”或“不移动”,)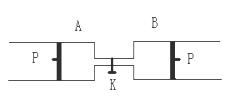
一定量的液态化合物XY2在一定量的氧气中恰好完全燃烧,生成两种气态产物,反应的化学方程式为:XY2 + 3O2 ══ XO2 + 2YO2,冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g/L ,则:
(1)反应前O2的体积是;XY2的质量是(保留小数点后两位)。
(2)化合物XY2的摩尔质量是。
(3)若XY2分子中X、Y两元素的质量比为3∶16,则X、Y两元素名称分别是和。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu + 8HNO3 ══ 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用单线桥法分析上述反应。
(2)上述反应的离子方程式为,还原产物是(填化学式)。标况下生成3.36L NO,被还原的硝酸的物质的量为。
标准状况下,①6.72L CH4 ②3.01×1023HCl分子 ③0.2mol NH3 ,这三种气体按质量由大到小排列的顺序是(填物质的数字代号,下同),按氢原子数由少到多排列的顺序是,密度由大到小排列的顺序是。