如图,一端封闭的U型管,封闭着的一端有一段CH4和Cl 2的混合气体,在水平部分有一段气柱,其他两段为液柱,已知液体与气体不反应,使CH4和Cl2在稍暗的光线下缓慢反应,则中间气柱的长度如何变化(假设中间气柱未移
2的混合气体,在水平部分有一段气柱,其他两段为液柱,已知液体与气体不反应,使CH4和Cl2在稍暗的光线下缓慢反应,则中间气柱的长度如何变化(假设中间气柱未移 出U型管的水平部分)( )
出U型管的水平部分)( )
| A.变大 | B.变小 | C.不变 | D.难以确定 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物的总能量一定低于反应物总能量 |
| B.吸热反应一定要加热条件才能进行 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件的△H不同 |
| D.用C(s)和CO(g)的燃烧热数据,可以计算化学反应C(s)+1/2O2(g)=CO(g)的焓变 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol |
B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g)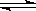 2NH3(g) △H=-38.6 kJ/mol 2NH3(g) △H=-38.6 kJ/mol |
| C.HCl 和NaOH 反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是
| A.Q1<Q3<Q2 | B.Ql<Q2<Q3 |
| C.Q1<Q2=Q3 | D.Q1=Q2=Q3 |
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
中和热测定实验中,下列操作会使测得的△H数值偏大的是
| A.大烧杯上没有盖硬纸板 |
| B.用环形铜丝搅拌棒代替环形玻璃搅拌棒 |
| C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 |
| D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验 |