右图是298K、101kPa时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )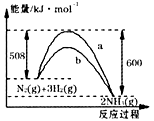
A.该反应的热化学方程式为: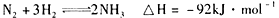 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1molN2和3molH2反应后 |
放出的热量为Q1kJ,若通入2molN2和6molH2反应后放出的热量
为Q2kJ,则184kJ·mol-1>Q2>2Q1
若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C.14 g氮气中含有7NA个电子 |
| D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4 |
某溶液中存在较多的OH-、K+、CO32-,该溶液中还可能大量存在的是
| A.H+ | B.Ca2+ | C.SO42- | D.NH4+ |
Na2O、NaOH、Na2CO3可按某种标准划为同一类物质,下列分类标准正确的是
① 钠的化合物;② 能与硝酸反应的物质;③电解质;④细分为:碱性氧化物、碱、盐;
| A.①②③ | B.①②③④ | C.②③ | D.②③④ |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下, 21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
下列操作不能用于检验NH3的是
| A.气体使湿润的酚酞试液变红 |
| B.气体能使湿润的红色石蕊试纸变蓝 |
| C.气体与蘸有浓H2SO4的玻璃棒靠近 |
| D.气体与蘸有浓盐酸的玻璃棒靠近 |