有关溶液中所含离子的检验,下列判断中正确的是 ( )
| A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl—存在 |
| B.加入氨水生成白色沉淀,氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在 |
| C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH+4存在 |
| D.加入盐酸有使澄清石灰水变浑浊的气体生成, 则原溶液中一定有大量CO2-3存在 |
有关实验的叙述,正确的是
| A.将浓硫酸加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的硫酸溶液 |
| B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 |
C.用 溶液洗涤并灼烧铂丝后,再进行焰色反应 溶液洗涤并灼烧铂丝后,再进行焰色反应 |
| D.读取量筒内液体的体积,俯视读数导致读数偏大 |
化学与人类生活、社会可持续发展密切相关。下列说法正确的是
| A.大量吃加碘食盐可以防止131I的辐射 |
| B.“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| C.用CO2合成聚碳酸酯可降解塑料,实现"碳"的循环利用 |
| D.为改善食品的色、香、味并防止变质,可加入大量食品添加剂 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
| A.若金属有剩余,在溶液中再滴入硫酸后,Fe又开始溶解,Cu不溶解 |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ cCl2↑+ dHClO4 + eH2O用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
| A.由反应可确定:氧化性HClO4>HClO3 |
| B.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
| C.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12 + I2 + 6H2O = 12H+ + 8Cl-+ 2IO3- |
| D.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O |
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是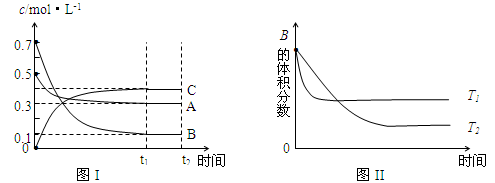
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g);△H>0
2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小