一定温度下,对可逆反应 A(g)+ B(g) 2C(g)的下列叙述中,能说明反应已达到平衡的是( )
2C(g)的下列叙述中,能说明反应已达到平衡的是( )
| A.单位时间内消耗amolA,同时生成2amolC |
| B.C生成的速率与C的分解速率相等 |
| C.若容器体积不变,容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
【改编】如图所示的电化学装置,下列叙述正确的是
| A.a和b用导线连接,溶液中的Na+向铁电极移动 |
| B.a和b用导线连接,碳电极的电极反应为:O2+2H2O-4e-=4OH— |
| C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀,属于牺牲阳极的阴极保护法 |
| D.若碳电极换成铜电极,氯化钠换成硫酸铜,a、b分别连接直流电源负、正极,可实现铁上镀铜 |
【改编】用NA表示阿伏伽德罗常数的值。下列叙述不正确的是
| A.标准状况下,22.4LCH4中含有4NA个C-H键 |
| B.48gO2与O3的混合气体中含有3NA个氧原子 |
| C.标准状况下,2.24L氯气溶于水转移的电子数为0.1NA |
| D.1L0.1mol/LFeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
【原创】下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
SO2有弱氧化性 |
SO2能使品红溶液褪色 |
| B |
SiO2能与氢氧化钠、氢氟酸反应 |
SiO2是酸性氧化物 |
| C |
碳酸钠能与酸反应 |
碳酸钠可作治疗胃酸过多的一种药剂 |
| D |
Ksp(CuS)、Ksp(HgS)均很小 |
可用Na2S除去废水中的Cu2+和Hg2+ |
【原创】25℃时,下列各组离子在指定溶液中能大量共存的是
| A.在弱碱性溶液中:Na+、K+、Cl-、HCO3- |
B.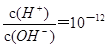 的溶液中:Na+、Al3+、SO42-、NO3- 的溶液中:Na+、Al3+、SO42-、NO3- |
| C.与镁反应生成氢气的溶液中:Na+、Fe2+、NO3-、Cl- |
| D.在苯酚溶液中:Fe3+、NH4+、Br-、SO42- |
【原创】下列说法正确的是
| A.蛋白质作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
| B.乙醇和丙三醇都含有羟基,二者互为同系物 |
| C.可用食醋除去热水壶内壁的水垢 |
| D.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |