钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是 ( )
| A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl |
| B.充电时阳极的电极反应为Na++e-===Na |
| C.放电时正极的电极反应为Ni2++2e-===Ni |
| D.该电池被称为绿色电池,最大原因是从废弃电池中可以 |
方便地回收较纯的镍,其他产物对环境没有影响
一定条件下,C0与H2反应可生成乙醇:2CO+4H2⇌ CH3CH20H+H20。下列关于该反应的说法错误的是
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
下列反应中,属于取代反应的是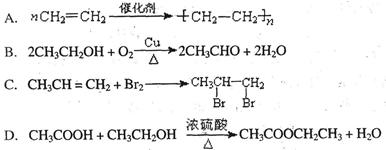
某原电池的结构如图所示,下列有关该原电池的说法中不正确盼是
| A.铁棒为正极 |
| B.铜棒发生还原反应 |
| C.电流从铜棒经外电路流向铁棒 |
| D.铁棒质量减轻 |
用 A表示阿伏加德罗常数的值。下列说法正确的是
A表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol Cl-离子中含有的电子数为8 A A |
B.标准状况下,2.24 L H20中含有的分子数为 A A |
C.27g铝与足量的氧气反应,转移的电子数为3 A A |
D.0.2 mo1·L-1 Ca(NO3)2溶液中含有的N03-离子数为0.4 A A |
下列有关实验原理或操作正确的是