31.某学校的课外活动小组要测定某块盐碱地中的NaCl、Na2SO4;、Na2CO3的含量,为盐碱地的改造提供依据。下面是他们的测定步骤:
(1)确定要测定地块的采样点。
(2)将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
(3)对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的阴离子都来自原土壤滤出液中)
(4)称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
请回答下列问题:
(1)设计采样点时有下列四种方案,选用方案__ __较为合理。
A B C D
(2)上述实验中试剂A的化学式是 ,试剂B的化学式是 ,气体和试剂C反应的化学方程式是__ 。
(3)若上述实验中试剂A为氯化钡溶液,则按上述实验步骤最终测得土壤中 的含量偏高。
如图是初中化学常见物质间的转化关系(部分反应条件和生成物已略去).已知:
,
是黑色固体粉末,
是一种蓝色溶液(波尔多液的成分之一),
是不溶于稀硝酸的白色沉淀.
试回答:
(1)写出
中溶质的化学式.
(2)
物质中元素的质量比是.
(3)写出反应①、②化学方程式,并注明反应①的基本类型.
反应①,反应类型.
反应②.
、 、 是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去):

(1)
物质的化学式是,
物质的俗称是,
物质的名称是.
(2)向
的块状固体上滴加水,观察到大量的水蒸气产生,该现象说明.
(3)举出
物质在农业生产中的一种用途:.
(4)反应②的化学方程式为,该反应可以用来检验二氧化碳气体,实验现象是.
(5)反应③的基本反应类型是,该反应前后碳元素的化合价(填"改变"或"不改变").
A~J分别是初中化学中常见的物质,它们存在如下转化关系。其中B、D、F、J均为无色气体且J能使湿润的红色石蕊试纸变蓝,A为红棕色固体,W是常见的一种化学肥料,E在常温下为无色液体,H的溶液呈蓝色。(反应中的个别生成物已略去)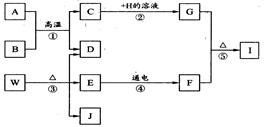
⑴写出化学式:A为 ,J为 , I为 。
⑵写出化学方程式反应① 反应③ 。
(3)在反应①~⑤中没有涉及的基本反应类型是 。
图14所示的是几种常见物质的转化关系,其中
是单质,甲、乙、丙、丁是氧化物.已知:丙是红色固体,
是最清洁的燃料,丙高温下与乙反应可生成
.(部分反应物、生成物及反应条件己略去)
请回答下列问题: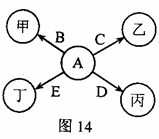
(1)丁的化学式为;
(2)甲的化学式可能为(只写一种);
(3)丙与乙反应的化学方程式为:;
(4)写出
的一条用途:.
有一包白色粉末,其中含有
、
,
,
中的一种或几种.某化学小组为确定白色粉末的成分,进行了如下实验:
(I)取一定量的白色粉末,加入足量水,震荡,得到无色透明溶液;
(II)取少量(I)的溶液,加入足量盐酸,有气泡产生.(提示:
的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?可能含有什么物质?
(2)为确定可能含有的物质是否存在,还需要做什么实验?请写出简要的实验步骤..