在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g) 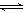 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡_________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
化学提高了人们生存的质量,生活质量的提高又促进了化学发展。
(1)柠檬中富含钾、钠、钙、柠檬酸等,属于性食品(填“酸性”或“碱性”);
(2)阿司匹林是人们熟知的治感冒药,具有解热镇痛作用。但长期大量使用会出现不良反应,如水杨酸反应。若出现水杨酸反应,应立即停药,并静脉滴注溶液。
(3)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离子方程式: 、。
、。
维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60 mg,微量元素碘约150 μg。 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变色。 某同学欲探究维生素C的还原性,可选择的试剂是(填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是(填序号)。 ①氨水、淀粉
①氨水、淀粉 ② KI溶液③酸性KMnO4溶液
② KI溶液③酸性KMnO4溶液 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为(填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为(填序号)。 ① I2
① I2 ② KI③ KIO3
② KI③ KIO3 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是。
环境和材料是现在社会中两大关注的问题,请回答:
(1)造成居室污染的物质是。 A.甲醛 B.氮气 C.一氧化碳 D.二氧化碳
A.甲醛 B.氮气 C.一氧化碳 D.二氧化碳
(2)形成酸雨的原因主要是由人为排放的(填字母,下同)转化而成的。
A.SO2 B.NO2 C.CO2 D.CO
(3)造成水体富营养化的主要原因是。
A.汞(Hg)、镉(Cd) B.N、P的化合物
C.石油泄漏 D.工厂排放酸、碱、盐
(4)造成白色污染的主要原因是。
A.废塑料制品 B.废铝制易拉罐
B.废旧电池 D.生活垃圾
(5)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程:。
(6)合金是被广泛应用的金属材料,下列有关合金性质的说法正确的是。
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的 性能就一定相同
性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
(7)塑料、合成橡胶和是常说的三大合成材料。
(8)下列条件下铁钉最容易生锈的是
A.浸泡在植物油中 B.浸泡在海水中
C.置于干燥的空气中 D.浸泡在蒸馏水中
下表是某食品包装上的说明,表中列出了部分配料。
配料中,富含维生素的是 (填序号,下同),属于调味剂的是 ,属于着色剂的是 ,属于防腐剂的是  。
。
(1)属于人体生命必需微量元素的是__________。(填”Fe”、”H”或 “Na”);
(2)乙烯经加聚反应生成的聚乙烯的结构简式是
_________________________。
(3)钢铁暴露在潮湿空气中发生电化学腐蚀的实质:钢铁表面的水膜与铁组成无数微小的______________________________。