下列离子方程式中,错误的是( )
| A.钠与水反应:Na+H2O = Na++OH-+H2↑ |
| B.盐酸与氢氧化钾溶液反应:H++OH-= H2O |
| C.铁与稀硫酸反应:Fe+2H+ = Fe2++H2↑ |
| D.氯化钠溶液与硝酸银溶液反应:Ag++Cl- = AgCl↓ |
用下图所示装置进行实验,下列对实验现象的解释不合理的是()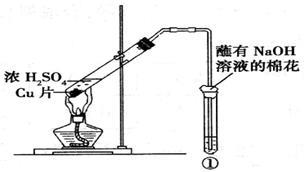
| 试管中试剂 |
试管中现象 |
解释 |
|
| A. |
硝酸酸化的BaCl2溶液 |
生成白色沉淀 |
白色沉淀为BaSO3 |
| B. |
品红溶液 |
溶液褪色 |
SO2具有漂白性 |
| C. |
紫色石蕊溶液 |
溶液变红 |
SO2水溶液显酸性 |
| D. |
酸性KMnO4溶液 |
紫色褪去 |
SO2具有还原性 |
工业上利用NaOH溶液来吸收、分离并利用CO2,其基本过程如下图所示(部分条件及物质未标出):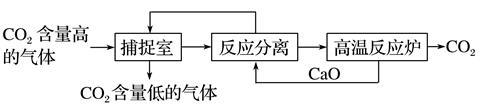
下列有关该方法的叙述中不正确的是()
| A.生产过程中,可循环利用的物质有CaO和NaOH |
| B.该方法涉及了化合、分解和复分解等反应类型 |
| C.该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 |
| D.“反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
下列实验中,所采取的分离方法与对应原理都正确的是()
| 选项 |
目的 |
分离方法 |
原理 |
| A. |
分离溶于水的碘 |
用乙醇萃取 |
碘在乙醇中的溶解度较大 |
| B. |
分离乙酸乙酯和乙醇 |
分液 |
乙酸乙酯和乙醇的密度不同 |
| C. |
除去KNO3固体中混杂的NaCl |
重结晶 |
NaCl在水中的溶解度很大 |
| D. |
除去纯碱中的碳酸氢铵 |
加热 |
热稳定性不同 |
为检验某溶液中是否含有SO42-、NH4+、Cl-、Fe3+等四种离子,某同学进行了下图所示的实验操作,已知检验过程中产生的气体能使湿润红色石蕊试纸变蓝。由该实验能得到的正确结论是()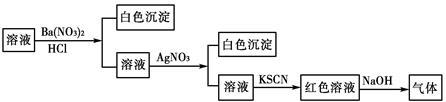
| A.原溶液中一定含有SO42- | B.原溶液中一定含有NH4+ |
| C.原溶液中一定含有Cl- | D.原溶液中一定含有Fe3+ |
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。取样分别完成以下实验:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是()
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |