据报道,我国的重庆市酸雨非常严重,为改变这一状况,重庆市正大力推广使用一种清洁能源,该能源是
| A.煤炭 | B.石油 | C.天然气 | D.氢气 |
下列装置所示的实验中,能达到实验目的的是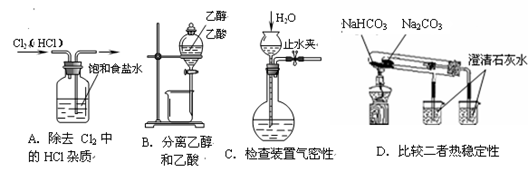
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
| A.酒精的燃烧热为Q3 kJ |
| B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
关于阿伏加德罗常数(用NA表示)的下列叙述完全正确的是
| A.1mol羟基(—OH)与17gNH3所含电子数都为NA |
| B.12.4g白磷(分子式为P4)中含有P-P共价键0.4 NA |
| C.由铜锌硫酸原电池中,当Cu极生成2.24LH2,则电路通过电子一定为0.2NA |
| D.将足量的铜屑加入到浓度均为2mol·L-1的HNO3和H2SO4的混合溶液100mL中,充分反应后,转移的电子数为0.45NA |
3月11日的日本大地震使福岛第一核电站受损,泄漏放射性物质131I、132I、和134Cs、137Cs等导致核污染。服用一定剂量的碘片可防放射性碘的伤害。被污染的水用硅酸钠来处理。下列说法错误的是
A.131I、132I、134Cs、137Cs是四种不同的核素 |
||
B.食用碘盐不能防辐射 |
C.碘片的主要成分是I2 |
D.用硅酸钠溶液处理污染水,主要利用该溶液具有的粘合性 |
北京奥运会火炬使用的燃料是一种常用燃料,其分 子式为C3H8,它属于
子式为C3H8,它属于
| A.烷烃 | B.烯烃 | C.炔烃 | D.芳香烃 |