下列实验可行的是
| A.用酒精萃取碘水中的碘 |
| B.加入盐酸以除去硫酸钠溶液中的少量碳酸钠杂质 |
| C.加热氯化铵与氢氧化钙的固体混合物制取氨 |
| D.在容量瓶中加入少量的水,再加入浓硫酸配制一定物质的量浓度的稀硫酸 |
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是 ( )。
| A.氢气的燃烧热为241.8 kJ·mol-1 |
| B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1 |
| C.盐酸和氨水混合的热化学方程式: H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.由③可知金刚石不及石墨稳定 |
100 g炭粉燃烧所得气体中,CO占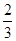 、CO2占
、CO2占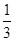 ,且C(s)+
,且C(s)+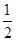 O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+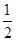 O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
| A.784.92 kJ | B.2 489.44 kJ | C.1 569.83 kJ | D.3 274.3 kJ |
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+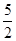 O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+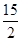 O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
| A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ |
| B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 ( )。