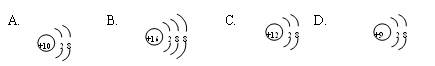氯气是一种重要的工业原料,工业上利用反应:3Cl2 + 2NH3 = N2 + 6HCl 检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2具有的氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol 电子转移 |
不能用Cl2跟金属单质直接化合制取的物质是
| A. AlCl3 | B. FeCl3 | C.CuCl2 | D. FeCl2 |
汤姆孙提出原子的葡萄干面包模型的主要依据是
①原子的构成中有电子②原子的构成中有质子③原子的构成中有中子④整个原子是电中性的
| A.①② | B.①④ | C.①③ | D.②④ |
对于 AZX和A+1ZX+两种粒子,下列叙述正确的是
| A.质子数一定相同,质量数和中子数一定不同 |
| B.化学性质几乎相同 |
| C.一定都由质子.中子.电子构成 |
| D.核电荷数,核外电子数一定相同 |
下列物质中含有Cl-的是B
| A.液氯 | B.氯化钠 | C.次氯酸钠 | D.氯酸钾 |
根据下列微粒结构示意图的共同特征,可把  三种微粒归为一类。下面的微粒可以归为此类的是
三种微粒归为一类。下面的微粒可以归为此类的是