已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF,由此可判断下列叙述不正确的是
| A.NaCN和HCN 物质的量比1︰1组成的混合溶液呈酸性 |
| B.物质的量浓度均为0.1mol·l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 |
| C.根据上述某两个反应即可得出电离常数大小的结论 |
| D.电离常数为:K(HCN)<K(HNO2)<K(HF) |
| A.用氨水洗涤试管壁上的银镜 |
| B.用渗析法除去氢氧化铁胶题体中少量盐酸 |
| C.用KMnO4溶液除去C2H4乙烯气体中少量SO2 |
| D.配制FeSO4溶液时,需加入稀硫酸和少量铁屑 |
工业上将苯蒸气通过炽热的铁合成一种传热载体化合物,其分子中苯环上的一氯代物有三种,1 mol该化合物催化加氢时最多消耗6 mol H2,则该传热载体化合物是 ( )
A. CH3—C6H5
B. C6H5—C6H5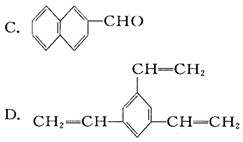
某有机物结构简式为 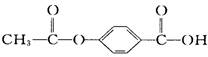 ,1 mol该有机物在合适的条件下与NaOH反应,最多可消耗NaOH的物质的量为 ( )
,1 mol该有机物在合适的条件下与NaOH反应,最多可消耗NaOH的物质的量为 ( )
| A.5 mol |
| B.4 mol |
| C.3 mol |
| D.2 mol |
扑热息痛是一种优良的解热镇痛剂,其结构式为 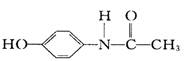 ,对此正确的说法是 ( )
,对此正确的说法是 ( )
| A.该物质水解后可得到 α-氨基酸 |
| B.该物质与苯丙氨酸互为同分异构体 |
| C.该物质能与浓溴水发生取代反应 |
D.该物质可由 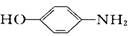 和CH3COOH缩聚而成 和CH3COOH缩聚而成 |
除去乙酸乙酯中含有的乙酸,最好的处理和操作是 ( )
| A.蒸馏 |
| B.用过量饱和Na2CO3溶液洗涤后分液 |
| C.用水洗后分液 |
| D.用过量的NaOH溶液洗涤后分液 |