已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
| A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
在离子浓度都为0.1 mol·L-l的下列溶液中,加入(通入)某物质后,发生反应的先后顺序排列正确的是
| A.在含Ag+、Cu2+的溶液中加入Zn:Ag+、Cu2+ |
| B.在含Fe3+、Br2的水溶液中滴加KI溶液:Fe3+、Br2 |
| C.在含NH4+、HCO3-的溶液中逐滴加入氢氧化钠溶液:NH4+、HCO3- |
| D.在含[Al(OH)4]-、OH-的溶液中逐滴加入盐酸:[Al(OH)4]-、OH- |
FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2易分解。实验室用稀硫酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是
| A.H2S | B.S | C.FeS | D.FeSO4 |
下列离子方程式正确的是
A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2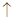 |
| B.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
C.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4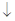 +H2O +H2O |
D.用小苏打类药物治疗胃酸过多:HCO3-+H+=CO2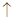 +H2O +H2O |
已知M、W、X、Y、Z是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,M原子的最外层电子数是电子层数的3倍,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素。下列说法中正确的是
| A.气态氢化物稳定性最强的是HZ |
| B.原子半径由小到大的顺序为W<M<Y |
| C.室温下,可用Y的容器盛装稀硝酸 |
| D.X的单质可通过电解XZ的水溶液获得 |
将反应4(NH4)2SO4=N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O的产物气体通入BaCl2溶液,下列判断正确的是
| A.无沉淀生成 |
| B.肯定没有BaSO3生成 |
| C.得到的沉淀是纯净物 |
| D.得到的沉淀是BaSO4和BaSO3组成的混合物 |