缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法错误的是
| A.加入少量强碱,主要发生的反应HPO42-+OH- PO43-+H2O |
| B.加入少量强酸,主要发生的反应HPO42-+2H+ H3PO4 |
| C.c(Na+)+c(H+)=c(OH-)+c(H2PO )+2c(HPO )+3c(PO ) |
| D.c(Na+)>c(PO )+c(HPO )+c(H2PO )+c(H3PO4)> c(Na+) |
足量的铝与20mL1.0mol/L的下列物质反应,产生气体物质的量最少的是
| A.氢氧化钠溶液 | B.稀硫酸 |
| C.盐酸 | D.稀硝酸 |
下列物质中的杂质(括号内为杂质),不能用在空气中加热的方法除去的是
| A.Na2O2(Na2O) | B.KCl(KClO3) |
| C.Na2CO3(NaHCO3) | D.NH4Cl(I2) |
下列说法不正确的是
| A.任何化学反应都伴随着能量变化 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.离子化合物中一定含有离子键,可能含有共价键 |
| D.强电解质与弱电解质的区别就是电解质在水溶液中是否完全电离 |
化学与生产、生活密切相关。下列说法不正确的是
| A.铵态氮肥不能与草木灰共同施用 |
| B.金属冶炼大多利用氧化还原反应原理 |
| C.聚酯纤维和光导纤维都属于新型无机非金属材料 |
| D.江河入海口形成的沙洲和卤水点豆腐都体现了胶体聚沉的性质 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的 沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.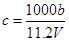 |
B.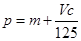 |
| C.n=m+0.017Vc | D.n=p+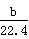 ×2 ×2 |