25 ℃下Ksp[Mg(OH)2]=5.6110-12 ,Ksp(MgF2)=7.4210-11 。下列说法正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,C(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 molL-1氨水中的Ksp比在20 mL 0.01molL-1NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
某同学设计如下实验测量m g铜银合金样品中铜的质量分数: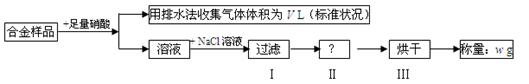
下列说法中不正确的是()
| A.收集到的V L气体全为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: ×100% ×100% |
下列溶液中有关微粒的物质的量浓度关系正确的是()
A.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):
c(Na+)=c(HRO3—)+2c(RO32—)
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:
c(Na+)>c(Cl—)=c(CH3COOH)
某同学按下图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是()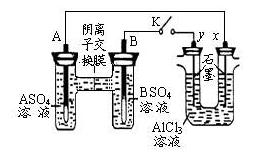
A.金属活动性A强于B
B.B 的电极反应:B-2e一= B2+
C.x电极上有 H2产生,发生还原反应
D.反应初期,x 电极周 围出现白色沉淀
围出现白色沉淀
已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: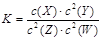 ,有关该平衡的说法中正确的是()
,有关该平衡的说法中正确的是()
| A.升高温度,平衡常数K变大 |
| B.增大压强,W(g)物质的量分数变小 |
| C.升温,若混合气体的平均相对分子质量变小,则逆反应放热 |
| D.增大Z浓度,平衡向正反应方向移动 |
利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成有机物A: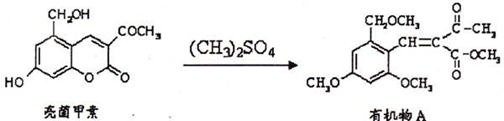
下列说法正确的是()
| A.亮菌甲素的分子式为C12H12O5 | B.亮菌甲素属于芳香族化合物 |
| C.A的核磁共振氢谱中有7个吸收峰 | D.1 mol A能跟5 mol氢气加成 |