设NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下的33.6L氯气与27g铝充分反应,转移的电子数为NA |
| B.标准状况下,2.24L水中约含有6.02×1023个氧原子 |
| C.由CO2与O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D.1L 1mol/LHCl溶液中含有HCl分子为NA个 |
除去Na2CO3固体中少量NaHCO3的最佳方法是
| A.加入适量盐酸 | B.加热 | C.加入适量NaOH溶液 | D.通入足量CO2气体 |
下列说法正确的是
| A.二氧化硅可以用来制造光导纤维 | B.工艺师利用盐酸刻蚀石英制作艺术品 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 | D.粗硅制备单晶硅不涉及氧化还原反应 |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法不能达到实验目的的是()
| 混合物 |
试剂 |
分离方法 |
|
| A |
苯(苯酚) |
氢氧化钠溶液 |
分液 |
| B |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| C |
乙酸乙酯(乙酸) |
氢氧化钠溶液 |
蒸馏 |
| D |
乙炔(硫化氢) |
硫酸铜 |
洗气 |
下列卤代烃中,能发生消去反应的是
| A.CH3Cl | B.CH3CH2-C(CH3)2CH2Br |
| C.CH3CH2-C(CH3)2Cl | D.CH2Br-CH(CH3)2 |
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。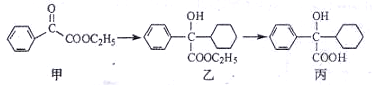
下列说法不正确的是()
| A.化合物甲中的含氧官能团有羰基和酯基 |
| B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应 |
| C.化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 |
| D.化合物丙能和氯化铁溶液发生显色反应 |