如图是向MgCl2、AlCl3混合液中依次加入M和N时生成沉淀的物质的量与加入的M和N的体积关系图(M、N各表示盐酸或氢氧化钠溶液中的一种),以下结论不正确的是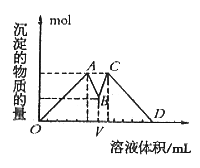
| A.混合溶液中c(AlCl3):c(MgCl2)=1:1 |
| B.混合溶液中c(AlCl3):c(MgCl2)=3:1 |
| C.V之前加NaOH溶液,V之后加盐酸 |
| D.这种盐酸与NaOH溶液中溶质的物质的量浓度相同 |
下列各反应的离子方程式中,错误的是( )
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH |
| B.氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-=Mg(OH)2↓ |
| C.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
D.NH4HCO3溶于过量的NaOH溶液中:HCO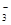 +OH-=CO +OH-=CO +H2O +H2O |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A.常温常压下,0.2NA个NH3分子的质子数NA |
| B.1 mol NaCl中,所有Na+的最外层电子总数为8NA |
| C.7.1g Cl2变为氯离子时,得到的电子数一定为0.1NA |
D.1L 0.2 mol/L硫酸铁溶液中含有的SO 离子数目为0.2NA 离子数目为0.2NA |
下列说法正确的是( )
| A.原电池是把电能转化为化学能的装置 |
| B.原电池两极均发生氧化还原反应 |
| C.原电池中的阳离子向正极移动 |
| D.原电池中电子流出的一极是正极,发生氧化反应 |
在一定温度下,一定体积的容器中,可逆反应:A(g)+3B(g) 2C(g)达到平衡的标志是( )
A.A、B、C的浓度相等
B.容器中压强不再变化
C.单位时间消耗 mol A,同时生成2n mol C
mol A,同时生成2n mol C
D.A、B、C的分子数比为1:3:2
已知短周期元素的离子aA3+,bB+,cC2-,dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.单质的还原性:A>B>D>C |