将含有0.4molNaCl和0.5molCu(NO3)2的水溶液用惰性电极电解一段时间后,在一个电极上得0.3molCu,则在另一个电极上逸出的气体(标准状况下)的体积是( )
| A.4.48L | B.5.6L | C.6.72L | D.11.2L |
下列反应中,不属于取代反应的是
| A.在催化剂存在条件下苯与溴反应制溴苯 |
| B.苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
| C.在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 |
| D.油脂在碱性条件下水解制肥皂 |
在通常条件下,下列各组物质的性质排列顺序正确的是
| A.熔点:CO2> KCI >SiO2 | B.水溶性:HCl> H2S> SO2 |
| C.沸点:乙烷>戊烷>丁烷 | D.热稳定性:HF> H2O> NH3 |
下列叙述错误的是:
| A.分子式为C5H12的烃,其一氯代物有3种 |
| B.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D.苯乙烯分子中所有原子可能在同一平面上 |
能正确表示下列反应的离子方程式是
| A.乙酸乙酯与氢氧化钠溶液反应: CH3COOC2H5+OH- → CH3COOH+ C2H5O- |
| B.用银氨溶液检验乙醛的醛基: CH3CHO +2Ag(NH3)2+OH- 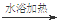 CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O |
| C.向苯酚钠溶液中通入少量的CO2: CO2 + H2O + 2C6H5O-  2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.甘氨酸与氢氧化钠溶液反应: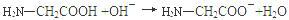 |
下列有机物检验方法正确的是
| A.取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 |
| B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯 |
| C.用燃烧的方法鉴别甲烷与乙炔 |
| D.用新制CaO检验乙醇中是否含有水分 |