室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。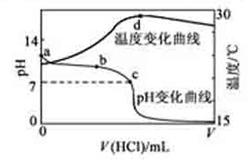
下列有关说法正确的是( )
| A.a点由水电离出的c(H+)=1.0×10-14mol/L |
| B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-) |
| C.c点:c(Cl-)= c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
对于可逆反应M+N Q 达到平衡时,下列说法中,正确的是( )。
Q 达到平衡时,下列说法中,正确的是( )。
A 反应混合物各成分的百分组成不再变化B.M、N全部变成了Q
C.M、N、Q三种物质的浓度一定相等D.反应已经停止
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量为△H1;等量的氢气在同样条件下完全燃烧生成液态水,放出热量为△H2;△H1与△H2的关系为
| A.△H1<△H2 | B.△H1=△H2 | C.△H1>△H2 | D.无法确定 |
关于金属钾的叙述中,错误的是( )。
| A.与水反应时,比钠还剧烈 | B.它的原子半径比钠的原子半径小 |
| C.密度比钠小 | D.它可以作还原剂 |
下列说法中,正确的是( )。
| A.在周期表中,族序数都等于该族元素的最外层电子数 |
| B.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 |
| C.卤素单质随原子序数的增大,其熔沸点逐渐降低 |
| D.碱金属随原子序数的增大,其熔沸点逐渐降低 |
Zn和Cu及硫酸形成的原电池,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录:
| 卡片No:28 Date:2014.3.8 实验后的记录: ①Zn为阳极,Cu为阴极;②H+向负极移动; ③电子流动方向为Zn→Cu;④Cu极有H2产生; ⑤若有1mol电子流过导线,则产生H2为0.5mol; ⑥正极电极反应式:Zn-2e=Zn2+。 |
在卡片上,描述合理的是
A.①②③ B.③④⑤ C.④⑤⑥D.③④⑥