为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验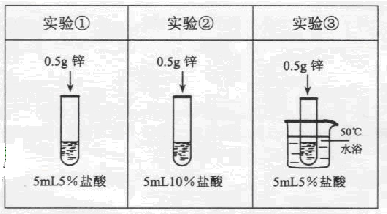
下列说法正确的是
| A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 |
| C.对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D.对比实验①和②,可研究温度对反应剧烈程度的影响 |
某同学对初中阶段所学化学知识进行分类归纳,其中叙述正确的是( )
A.化石燃料:煤、石油、天然气
B.碱:熟石灰、火碱、纯碱
C.微量元素:钙、铁、锌
D.合金:硬铝、生铁、金刚石
如图是常温下一些常见物质的pH,其中酸性最强的是( )
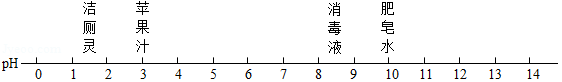
A.洁厕灵B.苹果汁C.消毒液D.肥皂水
2018年世界环境日中国主题是“美丽中国,我是行动者”。生活中下列做法不符合这一要求的是( )
A.提倡公交出行B.野外焚烧垃圾
C.循环使用教科书D.回收各种废弃塑料
化学与生活关系最为密切,下列说法不正确的是( )
A.用生石灰作食品干燥剂
B.生活中常用煮沸的方法软化硬水
C.煤炉上放一壶水,可以防止CO中毒
D.发现液化石油气泄漏,立即关闭阀门,同时打开门窗进行通风
下列化学用语书写正确的是( )
A.2个氧原子﹣2OB.2个氮分子﹣2N
C.钙离子﹣Ca+2D.氧化铜﹣CuO2