对于常温下pH为1的硝酸溶液,下列叙述正确的是
| A.该溶液1 mL稀释至100 mL后,pH等于2 |
| B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 |
| C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 |
| D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
下列关于阿佛加德罗常数的说法正确的是
| A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 |
| B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA |
| C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA |
| D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca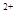 +2ClO +2ClO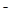 =CaCO3↓+2HClO =CaCO3↓+2HClO |
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO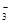 =CO =CO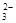 +H2O +H2O |
C.Fe3O4与稀HNO3反应:Fe3O4+8H =Fe =Fe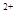 +2Fe +2Fe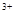 +4H2O +4H2O |
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO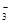 +Ca +Ca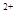 +OH +OH =CaCO3↓+H2O =CaCO3↓+H2O |
下列说法错误的是
| A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B.能自发进行的化学反应,焓变和熵变一定符合:△H<0、△S>0 |
| C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为纯碱 |
| D.用FeCl3饱和溶液制Fe(OH)3胶体的过程属于吸热过程 |
已知可逆反应:X(g)+3Y(g) 2Z(g)ΔH<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1 mol X和 3 mol Y ,在一定条件下达到平衡时放出热量为Q1KJ。在相同条件下,向乙容器中加入2 mol Z,达到平衡时吸收热量Q2KJ ,已知 Q1=3Q2。下列叙述正确的是
2Z(g)ΔH<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1 mol X和 3 mol Y ,在一定条件下达到平衡时放出热量为Q1KJ。在相同条件下,向乙容器中加入2 mol Z,达到平衡时吸收热量Q2KJ ,已知 Q1=3Q2。下列叙述正确的是
| A.平衡时甲、乙中Z的体积分数甲>乙 |
| B.平衡时甲中X的转化率为75% |
| C.达到平衡后,再向乙中加入0.25 mol X,0.75 mol Y和1.5 mol Z,平衡向生成x的方向移动[来源 |
D.乙中反应的热化学方程式:2Z(g)  X(g)+3Y(g) ΔH=+Q2kJ·mol-1[] X(g)+3Y(g) ΔH=+Q2kJ·mol-1[] |
已知A、B为单质,C为化合物。
能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④