用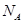 表示阿佛加德罗常数,下列说法正确的是( )
表示阿佛加德罗常数,下列说法正确的是( )
A.标准状态下22.4LS03分子数为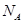 |
B.7.8gNa202含有的阴离子数是0.2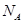 |
C.常温常压下,l6g02和16g03中所含原子数均为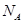 |
D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2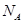 |
下列反应中,同时符合图像Ⅰ和Ⅱ的是
A.N2(g)+3H2(g)  2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g)  2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
C.H2(g)+CO(g)  C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
D.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
下列措施不能增大反应速率的是
| A.锌与稀硫酸反应时,加少量铜粉 |
| B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸 |
| C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉 |
| D.恒温时,增大H2(g)+Br2(g) ⇌2HBr(g)反应体系的压强 |
下列描述不符合生产、生活实际的是
| A.家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解水制氢气时,用铜作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
已知:N2(g)+3H2(g) ⇌ 2 NH3(g) △H =" -92.4" kJ/mol。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
| A.92.4>Ql>2Q2 | B.92.4=Q1<2Q2 |
| C.Q1=2Q2=92.4 | D.Q1=2Q2<92.4 |
在一密闭容器中,反应 aA(g)  bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
| A.平衡向正反应方向移动 | B.a>(b+c) |
| C.物质B的质量分数增大 | D.以上判断都错误 |