下列各组离子,在指定环境中一定能大量共存的是
| A.在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl- |
| B.在pH为7的溶液中:Ag+、Fe3+、SO42-、Cl- |
| C.在澄清透明的无色溶液中:Al3+、Cu2+、HCO3-、NO3- |
D.c(OH-)=1×10 -3mol/L的溶液中:K+、SO42-、Cl-、HCO3- -3mol/L的溶液中:K+、SO42-、Cl-、HCO3- |
在恒容密闭容器中A(g)+3B(g)  2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
下列推论正确的是
| A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的稀溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4kJ·mol-1 |
下列有机物的命名正确的是()
| A.3,3-二甲基丁烷 | B.3-甲基-2-丁烯 |
| C.2-乙基丁烷 | D.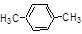 名称为1,4-二甲苯 名称为1,4-二甲苯 |