在0 .1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是
| A.加入水时,平衡向正反应方向移动,pH减小 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
常温下,有关下列4种溶液的说法正确的是
| ① |
② |
③ |
④ |
| 0.1 mol·L-1氨水 |
pH=11 氨水 |
0.1 mol·L-1盐酸 |
pH=3 盐酸 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-)
D.②与④等体积混合,混合液pH>7
根据下图海水综合利用的工业流程图,判断下列说法正确的是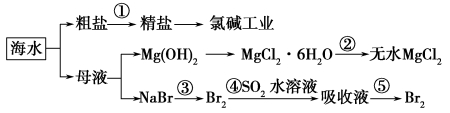
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为: NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第④步的目的是为了浓缩富集溴 |
X、Y、Z、W、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,W 元素的最高价氧化物的水化物可溶于Z元素的最高价氧化物的水化物,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
| A.原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) |
| B.氢气在R的单质中燃烧火焰呈蓝色 |
| C.元素X的氢化物的稳定性比Y的弱 |
| D.Y与Z形成的两种化合物中的化学键类型均相同 |
用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象及对应结论都正确的一项是
| 选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
| A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
| C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| D |
Cu,浓硝酸 |
淀粉KI试纸 |
变蓝 |
NO2为酸性气体 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.一定条件下,0.2molSO2与足量O2充分反应,生成SO3分子数为0.2NA |
| B.常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA |
| C.标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
| D.标准状况下,22.4L甲苯中含C—H数目为8NA |