重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等。工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2Cr04+H2S04.-----~Na2S04+Na2Cr207+H20
(1)反应①是在回转窑中进行,反应时需不断搅拌,
其目的是 。
。
(2)右图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶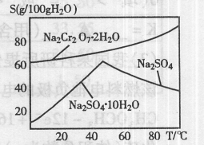
解度曲线。从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7,
晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现
用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶
解度见右表): 。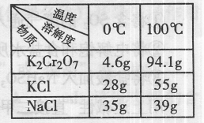
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:
步骤1:将mg铁矿石加浓盐酸加热溶 解
解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化
为Sn4+
步骤4:加人15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol·L。重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式 。
②如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
③步骤5使用的玻璃仪器有
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_________________________;②_________________________;将处理后的气体充入座舱时,应注意采取的一项措施是___________________________。有人提出用超氧化钾(KO2)代替过氧化钠供氧,预计其优点是_________________________________。
用A、B两种常见化合物组成混合物,A、B的焰色反应均为黄色,其相互转化关系如下图(其他物质略去)。
根据以上关系,完成下列问题:
(1)写出A、B、C、D的化学式:
A_____________________________________,
B_____________________________________,
C_____________________________________,
D_____________________________________。
(2)写出混合物与水反应的化学方程式:___________________________________________。
(3)加热后,若只得到一种固体化合物,则A与B的质量之比的最大值为___________。
有A、B、C、D、E、F、G、H、I九种常见物质。已知:①其中只有B、C、F为单质,且常温常压下,B为固态,C、F为气态;②化合物中仅A、E为气态;③在常温下,D为淡黄色粉末;④H的焰色反应呈黄色。它们的转化关系(反应条件未注明)如图所示:
试完成下列问题:
(1)写出A与D反应的化学方程式:______________________________________________。
(2)写出B与G反应的化学方程式:______________________________________________。
(3)写出D的电子式和A的结构式:______________________________________________。
(4)用电子式表示G的形成过程。________________________________________________。
A、B、C、D、E、F六种物质都易溶于水,水溶液除F外都能使石蕊试液变蓝色,六种物质火焰都呈黄色。A、B与水反应时,都有气体产生,A放出的气体具有还原性,B放出的气体具有氧化性,A、B溶于水时都产生C。C与适量的二氧化碳反应生成D,C与过量二氧化碳反应生成E,而固体E加热时产生D。F的水溶液能使石蕊试液变红色,在F的溶液中加入氯化钡溶液产生白色沉淀,F与D反应产生二氧化碳。试推断六种物质分别是:A____________,B_____________,C____________,D____________,E____________,F____________。(填化学名称)
各物质间的转化关系如下图所示:
(1)写出反应③的化学方程式: ,生成标准状况下5.6 L气体甲,则转移电子的物质的量为 mol。
(2)固体A是一种重要的工业原料,1 mol气体乙完全燃烧时生成1 mol E与2 mol丙,则乙的电子式为 。
(3)C溶液中的溶质和丙以物质的量之比1∶2反应时,该反应的离子方程式为: 。
(4)利用图中的有关物质,实现C→B的转变,该物质为 (填写化学式)。
(5)若甲和乙恰好完全反应,则A与W的物质的量之比为 。