对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是( )
| A.增加某反应物的质量 | B.使用催化剂 |
| C.降低反应体系的压强 | D.升高温度 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是
| A.常温时,在正负极间接上电流表或检流计,指针不偏转 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.2mol电子,理论上生成41.4g Pb |
| D.正极反应式:Ca+2Cl--2e-===CaCl2 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
| A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 |
| B.根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| C.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| D.根据HCl的酸性远强于H2S,可推出结合质子能力:S2-<Cl- |
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑ |
| B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: 2Al3++3SO42-+3Ba2++6OH-="==2" Al(OH)3↓+3BaSO4↓ |
| C.氯化钠与浓硫酸混合加热:H2SO4+2Cl-===SO2↑+Cl2↑+H2O |
| D.向AgCl悬浊液中滴加Na2S溶液;白色沉淀变成黑色2AgCl+S2-===Ag2S↓+2Cl- |
用图所示装置进行下列实验:将①中溶液滴入锥形瓶中,预测的现象与实际相符的是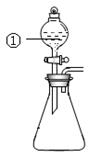
| 选项 |
①中物质 |
锥形瓶中物质 |
预测锥形瓶中的现象 |
| A. |
浓盐酸 |
“84”消毒液 |
有黄绿色气体产生 |
| B. |
浓硝酸 |
光洁的铁钉 |
产生红棕色气体 |
| C. |
氯化铝溶液 |
浓氢氧化钠溶液 |
先有白色沉淀生成,后沉淀又溶解 |
| D. |
草酸溶液 |
酸性高锰酸钾溶液 |
溶液逐渐褪色, 有黑色沉淀生成 |
分子式为C5H10O2的有机物A,有果香味,不能使紫色石蕊试液变红,但可在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有
| A.1种 | B.6种 | C.8种 | D.18种 |