将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。可以判断该分解反应已经达到化学平衡的是( )
| A.2v(NH3)= v(CO2) | B.密闭容器中气体的总物质的量不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中二氧化碳的体积分数不变 |
如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素。下列说法正确的是
| 甲 |
乙 |
||
| 丙 |
丁 |
||
| 戊 |
A.原子半径:甲>乙
B.丁和戊的原子核外电子数相差8
C.最高价氧化物对应的水化物的酸性:丙>丁
D.甲的单质在空气中燃烧生成只含共价键的化合物
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
在酒精灯上加热铝箔 |
铝箔熔化但不滴落 |
熔点:铝>氧化铝 |
| B |
某酸雨试样中加入Ba(OH)2溶液 |
产生白色沉淀 |
酸雨试样中只含SO42- |
| C |
用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 |
试纸变黑 |
浓硫酸具有脱水性 |
| D |
食用加碘盐加入食醋和KI溶液,再加入CCl4振荡,静置 |
下层呈紫红色 |
该食用加碘盐含有KIO3 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) |
| B.0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| C.0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
| D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是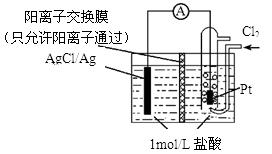
| A.正极反应为Ag-e-=Ag+ |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
| D.用KCl溶液代替盐酸,则电池总反应不改变 |
设nA为阿伏伽德罗常数的数值,下列说法正确的是
| A.1L 0.1mol/L的醋酸溶液含有0.1nA个H+ |
| B.1molSiO2与足量的焦炭高温下完全反应生成硅,转移4nA个电子 |
| C.标准状况下,11.2L H2O含有共价键的数目为nA |
| D.常温常压下,14 g 由N2与C2H4组成的混合气体含有的原子数目为nA |