已知700K时,N2+3H2  2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
| A.Q = Q1 = 1/2Q2 | B.Q>Q1>2Q2 |
| C.Q>2Q2>Q1 | D.Q = Q1 =Q2 |
某有机物燃烧后产物只有CO2和H2O,可推出的结论是这种有机物中
A.一定含有C、H、OB.可能 含有C、H、O
含有C、H、O
C.一定含有C、H、无OD.一定含有C、H、可能有O
下列说法错误的是
| A.化学反应中的能量变化与化学键变化有关 |
| B.化学反应中能量变化的大小与反应物的质量多少有关 |
| C.煤、石油、天然气是当今世界最重要的三种化石燃料 |
| D.人体运动所消耗的能量与化学反应无关 |
下列元素原子半径最大的是
| A.C1 | B.Na | C.H | D.F |
元素性质呈周期性变化的决定因素是
| A.元素原子最外层电子排布呈周期性变化 | B.元素相对原子质量依次递增 |
| C.元素的最高正化合价呈周期性变化 | D.元素原子半径大小呈周期性变化 |
用系统命名法对有机物,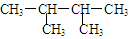 命名正确的是
命名正确的是
| A.2.3—二甲基丁烷 | B.二甲基丁烷 | C.2.3—甲基丁烷 | D.己烷 |