700℃时,向容积为2L的密闭容器中充入一定量的CO和H 2O,发生反应:
2O,发生反应:
CO(g)+H2O(g)  CO2+
CO2+ H2(g) 反应过程中测定的部分数据见下表(表中t1>t2):
H2(g) 反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
下列说法不正确的是()
| A. | 变色硅胶干燥剂含有 ,干燥剂呈蓝色时,表示不具有吸水干燥功能 |
| B. | "硝基苯制备"实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
| C. | "中和滴定"实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用 |
| D. | 除去干燥 中混有的少量 ,可将混合气体依次通过盛有酸性 溶液。浓硫酸的洗气瓶 |
下列说法不正确的是()
| A. | 化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律 |
| B. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团 |
| C. | 分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,面对溶解度无影响 |
| D. | 酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义。 |
将 (腺苷酸脱氨酶基因)通过质粒 导入大肠杆菌并成功表达腺苷酸脱氨酶。下列叙述错误的是
| A. | 每个大肠杆菌细胞至少含一个重细胞质粒 |
| B. | 每个重组质粒至少含一个限制性核酸内切酶识别位点 |
| C. | 每个限制性核酸内切酶识别位点至少插入一个 |
| D. | 每个插入的 至少表达一个腺苷酸脱氨酶分子 |
室温下,将1.000
 盐酸滴入20.00
1.000
盐酸滴入20.00
1.000
 氨水中,溶液
和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是( )
氨水中,溶液
和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是( )
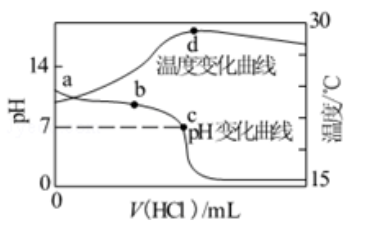
| A. |
点由水电离出的

|
| B. |
点:

|
| C. | 点: |
| D. |
点后,容易温度略下降的主要原因是
 电离吸热
电离吸热 |
研究人员最近发现了一种"水"电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5 +2 +2 = +2 下列"水"电池在海水中放电时的有关说法正确的是:()
| A. | 正极反应式: |
| B. | 没生成1 mol 转移2 mol电子 |
| C. | 不断向"水"电池的负极移动 |
| D. | 是还原产物 |