(16分).铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图 1 知金属铬的活动性比铜_____(填强,弱),图 2装置中铬电极的电极反应式 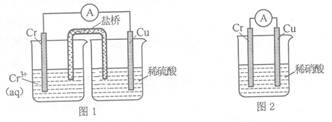
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸, CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为_____________________________________________________________。
(3)存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡体系的pH=2,则溶液显 色.
②能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L1,则溶液中c(Cr3+)为____ mol·L-1。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。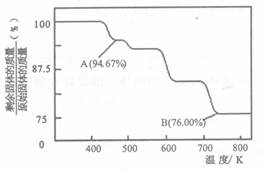
从开始加热到 750K 时总反应方程式为_______________________。
近几年来,我国中东部地区陷入严重的雾霾天气,面对全球近期的气候异常,环境问题再次成为焦点。非金属氧化物的合理控制和治理是优化我们生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
Ⅰ、目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-57kJ•mol-1
②4CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式________________。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+ 2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度(mol/L) 时间(min) |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T℃时该反应的平衡常数为____________(结果保留两位有效数字)。
②30 min后改变某一条件,反应重新达到平衡,则改变的条件可能是___________________。
③若30min后升高温度重新达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应
△H_________0(填“<”“>”“=”)。
Ⅱ、某科研小组为治理SO2对大气的污染,利用烟气中的SO2为原料制取硫酸。
(1)利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式__________。
(2)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液。
①常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-)
②然后电解该NaHSO3溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式______________________________________。
(12分) 类推法是科学学习的重要方法之一
⑴下列类推结论正确的是
| 类比对象 |
结论 |
|
| A |
Cl2+H2O HCl+HClO HCl+HClO |
I2+H2O HI+HIO HI+HIO |
| B |
C+2CuO ="==" 2Cu+CO2↑(条件:加热) |
C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C |
Na2O+H2O ="=" 2NaOH |
CuO+H2O ="=" Cu(OH)2 |
| D |
Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO |
Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
⑵ 在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质,请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
450 |
|
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
硒的熔点范围可能是_______ ;
② 碲的化合价可能的范围_______ ;
③ 硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式);
④ 氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为___________________________________。
(8分)下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① |
||||||||
| ② |
③ |
④ |
||||||
| ⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
请按要求回答下列问题:
⑴ 画出元素②的原子结构示意图。
⑵ 属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
⑶③、⑦两种元素相比较,非金属性强的是(填元素符号)。
⑷ 元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是,。
⑸ 元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式:。
氧、硫、氯是中学化学重点研究的非金属元素,回答下列问题:
⑴三种元素形成的常见氢化物中稳定性最差的是_______,沸点最高的是____,其沸点最高的主要原因是________。
⑵硫单质与铁在加热时反应的方程式是_______,通过硫和氯的单质分别与铁的反应对比,从氧化还原角度可以得出的结论是________。
(7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。
a.浓盐酸 b.浓硫酸c.浓硝酸