某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ·mol-1 |
| B.逆反应活化能一定小于100kJ·mol-1 |
| C.正反应活化能不小于100kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100kJ·mol-1 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
依据下表判断CH3CH3 CH2=CH2+H2的反应热为
CH2=CH2+H2的反应热为
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ·mol-1) |
414.4 |
615.3 |
347.4 |
435.3 |
A.125.6kJ·mol-1B.-125.6kJ·mol-1
C.46.1kJ·mol-1D.-46.1kJ·mol-1
工业制氢气的一个重要反应是: 已知在25℃时:
已知在25℃时: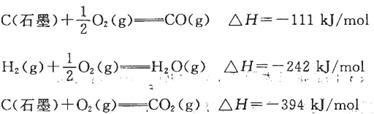
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为
| A.+41.kJ/mol | B.-41kJ/mol | C.283kJ/mol | D.-131kJ/mol |
密闭容器中有如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
| A.m+n>p | B.A的转化率降低 |
| C.平衡向正反应方向移动 | D.C的质量分数增加 |
合成氨反应的正反应是气体体积减小的放热反应。合成氨工业的生产流程如下:
关于合成氨工业的说法中不正确的是
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |