(5分) 可用于分离或提纯物质的方法有:
| A.过滤 | B.萃取分液 | C.蒸馏法 | D.洗气法 E. 加热分解 |
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填字母序号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用
(2)除去O2中少量的水蒸气,用
(3)提取碘水中的碘,用
(4)除去Na2CO3固体中的NaHCO3,用
(5)海水中提取淡水,用
有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是___________。
(2)生成红褐色沉淀的原因是____________________________。
(3)写出生成气泡速率明显加快的两个原因____________、_____________。
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 |
氢氧化钠溶液的体积 |
|
| 滴定前刻度(mL) |
滴定后刻度(mL) |
|
| 1 |
0.00 |
5. 01 |
| 2 |
6.00 |
10.99 |
| 3 |
12.00 |
17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是; b的作用是
;冷凝管中从(填“n”或“m”)口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是。
(5)利用题目中所给数据计算肥料中总氮含量为%(计算结果保留到小数点后1位)。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)上述操作步骤①中错误是 (请指出
具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
(3)步骤②缺少的操作是
(4)某次滴定时的滴定管中的液面如图,其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。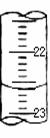
(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
①应该选用的仪器及装置有(填字母)。
②生石灰与氯化铵反应生成氨气的化学方程式为。
(2)该小组同学设计如图16所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为。
某学业生利用以下装置制备氨气,并完成氨气的喷泉实验。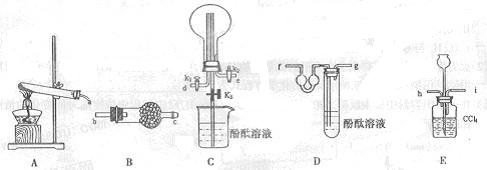
请回答下列问题:
(1)装置A中发生反应的化学方程式。
(2)装置B中所盛的试剂是。
(3)如果将制备氨气和氨气喷泉组合为一整套实验,用字母表示接口的连接顺序:
()、()、C、()()()()()
(4)组装好装置,检查装置的气密性后,加入试剂关闭K3,打开K1、K2给A装置试管进行加热。当(填写现象)时,即烧瓶中氨气收满。
(5)装置E的作用。
(6)请叙述引发该喷泉实验的操作过程。