(17分) 重庆有丰富的天然气资源。以天然气为原料合成氨的主要步骤如下图所示(图中某些转化步骤及生成物未列出):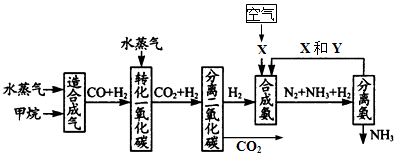
请填写下列空白:
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是_______________________________。
(2)图中X为_____,Y为_____(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为_____________________________________
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来。请运用化学平衡的观点说明采取该措施的理由:_______________________________。
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图所示
①应先向食盐水通足量_______气体(写化学式,后同);副产品Z为______,可用作______;W为_______。
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z_______吨。
经精选后的铝土矿A(主要成份为Al2O3,含有一定量的Fe2O3、SiO2杂质),可用A来制备电解铝原料——氧化铝,某课外小组同学模拟该过程,设计了如下方案:
请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __
钠、铝和铁是三种重要的金属。请回答:
(1)钠原子的结构示意图是________________。
(2)三种金属中,既能与盐酸又能与氢氧化钠溶液反应的是_________(填化学式),写出其与氢氧化钠溶液反应的离子方程式________。
(3)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式是_____________________。取一小块金属钠放在滴有酚酞的水中,实验现象正确的是________(填选项)。
①钠浮在水面迅速反应②钠沉在水底迅速反应③钠熔成小球并快速游动
④反应中可以听到嘶嘶的响声⑤反应后的溶液变为红色
a. ①④⑤ b. ②③④⑤ c. ①③④⑤
(4)铁、铝是常用的金属材料,在空气中铝比铁更耐腐蚀。对此合理的解释是______ __________________________。
在放电条件下,氮气与氧气可直接化合:N2+O2 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
芳香化合物A、B互为同分异构体,B的结构简式是CH3COO- -COOCH2CH3
-COOCH2CH3
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示: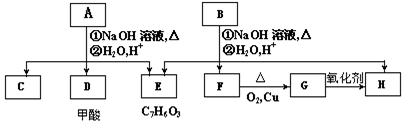
(1)B可以发生的反应类型有(填序号)。
①加成反应②酯化反应③消去反应④取代反应⑤聚合反应
(2)E中含有官能团的名称是。
(3)A有两种可能的结构,其对应的结构简式为,。
(4)B、C、D、F、G化合物中互为同系物的是。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为:。
已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式;D元素的价电子排布式。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是(填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图: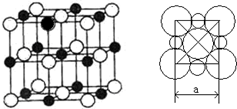 若
若
a=5.6×10-8cm,则该晶体的密度为g·cm-3(精确到小数点后1位)。