(1) 体积相同,pH相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率_____________,充分反应后,产生氢气的量_____________(相同、盐酸的多、醋酸的多)
(2) 在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入__________晶体,要使产生氢气的量不变,但反应速率减慢,可加入____________晶体。
可选择的晶体有:
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 (E) KHSO4 |
(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
在虚线框内连接合适的装置___________________
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量____________________________________。
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。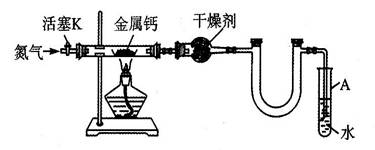
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
| 直玻管质量m0/g |
直玻管与钙的质量m1/g |
直玻管与产物的质量m2/g |
| 14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= 。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
用KOH固体配制质量分数为28%的KOH溶液(ρ=1.1g/mL)。
(1)溶液中OH-与H2O分子个数之比为 ,溶液的物质的量浓度为 。
(2)若需配制上述溶液95mL,则需称量KOH固体 克,需用到的玻璃仪器有: 。
(3)容量瓶使用前检漏的操作为: 。
(4)下列操作中,使所得KOH溶液浓度偏大的是 。
| A.称量KOH固体时,直接用纸称量; |
| B.KOH固体溶解后,未完全冷却就转移至容量瓶中; |
| C.定容时,俯视容量瓶标线; |
| D.配制溶液前,容量瓶未完全干燥; |
E、转移溶液时,有少量液体溅出
.在实验室中用二氧化锰跟浓盐酸反应制备干燥且较纯净的氯气。进行此实验,所用仪器如下图:
(1)连接上述仪器的正确顺序是(填各接口处的字母):
接,_____接,_____接,接。
(2)在装置中:
①饱和食盐水的作用是,
②浓硫酸的作用是。
(3)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:;
②尾气吸收装置中进行的反应:。
(4)MnO2是______色的粉末状固体,在该实验中MnO2所起得作用是____________
(5)若实验操作正确,在集气瓶内若放一块干燥的有色布条,在实验进行的过程中,有色布条能否褪色?(填“能”或“不能”)________.
用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③,④冷却,⑤移液,⑥洗涤并移液,⑦,⑧摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是:。使用容量瓶前必须进行的操作是。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:。
③定容是俯视刻度线:。
NaCl中混有少量的硝酸钾,要除去硝酸钾,所用的方法是___________________,汽油和水的混合物分离的方法是____________