下列各反应的离子方程式中,书写正确的是( )
| A. NaOH溶液与硫酸反应: 2H+ + 2OH- = 2H2O |
| B. FeCl3和Fe反应: Fe3+ +Fe = 2Fe2+ |
| C.硫酸和氢氧化钡反应: H+ + SO42- + Ba2+ +OH- = H2O + BaSO4 |
| D.氧化铜和稀盐酸反应: CuO + 2H+ = Cu2+ + H2O |
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是()
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 | B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 | D.溶液的pH增大 |
相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是()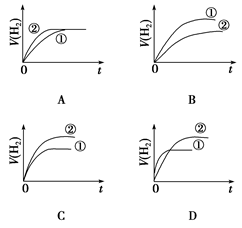
25 ℃时,0.1 mol·L-1稀醋酸加水稀释 ,如图中的纵坐标y可以是( )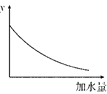
| A.溶液的pH | B.溶液的导电能力 | C.醋酸的电离平衡常数 | D.醋酸的电离程度 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知
2Z(g),已知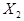 、
、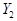 、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()
、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()
| A.Z为0.3mol/L | B.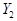 为0.4mol/L 为0.4mol/L |
C.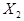 为0.2mol/L 为0.2mol/L |
D. 为0.4mol/L 为0.4mol/L |