用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:
(1)配制稀硫酸时,应选用容量为________mL的容量瓶;
(2)经计算需要用量筒量取________mL浓硫酸,在量取时宜选用下列量筒中的____(填字母).
| A.5mL | B.10mL | C.15mL | D.50mL |
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1-2cm处,改用胶头滴管加蒸馏水,使溶液的凹液面底部与瓶颈的环形标线相切。
③在盛硫酸的烧杯中注入蒸馏水少量,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶上述操作中,正确的顺序是(填序号)________。
(4)指出本实验操作错误的地方,并进行更正______________________________________
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓硫酸,其配制的稀硫酸浓度会________(填“偏高”、“偏低”、“无影响”,下同).若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀硫酸浓度会________。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一 红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
I.设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN 试剂。
(1)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体 ,写出发生反应的离子方程式:
II.探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(2)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
4.7 |
5.5 |
2.4 |
| 沉淀完全pH |
6.7 |
9.4 |
3.7 |
设计实验方案: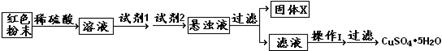
可供选择试剂:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |
试回答:①试剂1为,试剂2为(填字母)。
②固体X的化学式为。③操作I为。
(3)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为 。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下图:
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如图所示,则A、B分别连直流电源的和极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:。A极发生的电极反应式为。
B极发生的电极反应式为_____________________________________。
(4)下列实验操作中必要的是(填写字母) 。
。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有n、V的式子表示)。
(9分,每空1分)某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的,因为;
(2)写出甲酸进行银镜反应的化学方程式:;
(3)某同学做银镜反应失败,他可能进行的错误操作有________(写字母):
| A.用洁净的试管; | B.在浓度为2%的NH3·H 2O中滴入稍过量的浓度为2%的硝酸银; 2O中滴入稍过量的浓度为2%的硝酸银; |
| C.用临时配制好的银氨溶液; | D.在银氨溶液里加入稍过量的甲酸; |
E.反应过程中,没有振荡试管.
然后,同学们对甲酸与甲醇进行了酯化反应的研究: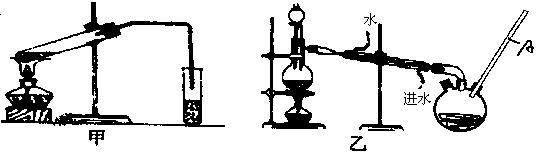
(4)乙装置中长导管A的作用是;
(5)选择甲装置还是乙装置好?________,原因是;
(6)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有________、________两种必备用品.
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I—1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸
钙的纯度会(填“偏高、偏低、无影响”)。
问题I—2:在方框中画出测定生成的气体体积的装置简图。
【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II—1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无);
理由是。
问题II—2:碳酸钙纯度表达式。
【方案评价】
你认为以上两个方案中,最好的方案是,
另一个方案不够好的理由是。
(共6分,每空2分)铜是日常生活中常见的金属。已知铜的原子序数为29。回答问题: (1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式。
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式。 (2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
 (3)写出你所设计装置中的化学反应的方程式。
(3)写出你所设计装置中的化学反应的方程式。